新冠戰(zhàn)“疫”進入第三個年頭,全球疫情仍在蔓延,世界多國面臨著疫情防控的嚴峻挑戰(zhàn)。
截至目前,全球累計新冠肺炎確診病例數(shù)已經(jīng)超過5億例,這距離1月初的3億例僅過去3個月的時間。此外,3月1日-4月18日,我國31個省(自治區(qū)、直轄市)和新疆生產(chǎn)建設(shè)兵團累計報告本土感染者497214例,波及除西藏自治區(qū)以外的所有省份。
在新冠病毒不斷變異與持續(xù)肆虐下,全球大流行至今尚未迎來“拐點”。在此形勢下,疫苗作為抵御新冠病毒的首道防線,依舊是人類應(yīng)對危機的最有效手段。
據(jù)國家衛(wèi)健委數(shù)據(jù)顯示,截至2022年4月23日,31個省(自治區(qū)、直轄市)和新疆生產(chǎn)建設(shè)兵團累計報告接種新冠病毒疫苗332976.6萬劑次。另據(jù)牛津大學(xué)Our World in Data統(tǒng)計數(shù)據(jù),截至英國倫敦時間4月21日16時(北京時間4月21日23時),全球累計報告接種新冠病毒疫苗114.9億劑次,世界人口的65%至少接種了一劑新冠疫苗。
不過,如今完成全程疫苗接種已不足以筑牢免疫屏障,而接種加強針,成為現(xiàn)階段在全球范圍內(nèi),有效減少新冠重癥和死亡率最有效、最可行的途徑之一。4月21日,在博鰲亞洲論壇2022年年會上,國務(wù)院聯(lián)防聯(lián)控機制疫苗研發(fā)專班工作組組長鄭忠偉也指出,隨著疫情演變,兩年多的實踐已證明,兩針不足以達到最好的保護效果,接種第三針勢在必行。
早在去年10月,我國就啟動了新冠疫苗加強針接種(同源加強免疫),隨后在今年2月,國家衛(wèi)生健康委開始部署序貫加強免疫接種(俗稱“混打”)。
2月19日,國務(wù)院聯(lián)防聯(lián)控機制新聞發(fā)布會宣布,凡全程接種國藥中生北京公司、武漢公司、北京科興公司滅活疫苗,以及天津康希諾公司的腺病毒載體疫苗滿6個月的18歲以上目標人群,可以進行一劑次同源加強免疫,也就是用原來的疫苗進行加強。序貫加強免疫策略實施后,完成全程接種上述三種滅活疫苗的目標人群,還可以選擇智飛龍科馬的重組蛋白疫苗或康希諾的腺病毒載體疫苗進行序貫加強免疫。
據(jù)國家衛(wèi)健委通報,截至4月18日,全國累計報告接種新冠疫苗33億1746.3萬劑次,接種總?cè)藬?shù)為12億8212萬,已完成全程接種12億4676.9萬人,覆蓋人數(shù)和全程接種人數(shù)分別占到全國總?cè)丝诘?0.94%和88.43%。完成加強免疫接種7億3265.9萬人,其中序貫加強免疫接種2542.6萬人。60歲以上老年人的疫苗接種,覆蓋人數(shù)達到2億2552.1萬,完成全程接種2億1393.8萬,覆蓋人數(shù)和全程接種人數(shù)分別占老年人口的85.41%和81.03%。加強免疫接種已經(jīng)完成1億5487.4萬人。
從數(shù)據(jù)可見,目前我國老年人新冠疫苗接種率整體偏低。這也為后續(xù)國內(nèi)疫苗企業(yè)帶來了發(fā)展機遇,尤其是獲批序貫加強疫苗的企業(yè)。然而,隨著新冠疫苗上半場競爭逐漸收尾,盡管國內(nèi)疫苗接種需求巨大,由于“后來者”入局較晚,其新冠疫苗大多仍處于臨床試驗階段,下半場的序貫加強之爭態(tài)勢如何,仍屬未知。
出品|21世紀新健康研究院
撰寫|21世紀新健康研究院高級研究員朱萍 實習(xí)生 胡冰月 歐陽馨月 李雯含
編輯|徐旭
設(shè)計|徐暉
第一部分:國內(nèi)外疫情形勢嚴峻復(fù)雜
當前,全球疫情形勢嚴峻依舊,新一輪疫情向多國襲來,各國新增確診病例不斷。
根據(jù)Worldometer實時統(tǒng)計數(shù)據(jù),截至北京時間2022年4月22日6時30分左右,美國累計確診新冠肺炎病例82532355例,累計死亡病例1017449例;與前一日6時30分左右數(shù)據(jù)相比,美國新增確診病例91023例,新增死亡病例1108例。
此外據(jù)公開報道,4月以來,美國部分政府官員及國會議員陸續(xù)確診。當?shù)貢r間4月11日,美國密歇根州眾議員塔利布(Rashida Tlaib)宣布其新冠肺炎檢測結(jié)果為陽性,確診后目前正在家隔離。4月10日,美國紐約市政府發(fā)表聲明稱,紐約市長亞當斯當日新冠病毒檢測結(jié)果呈陽性,目前未出現(xiàn)其他癥狀,已進行隔離并將取消公開活動。4月9日,美國農(nóng)業(yè)部長湯姆·維爾薩克稱其新冠病毒檢測結(jié)果呈陽性,成為又一名確診新冠的美國部長。4月7日,美國眾議院議長佩洛西的新冠病毒檢測結(jié)果呈陽性。4月6日,美國商務(wù)部長雷蒙多和司法部長加蘭先后確診感染新冠病毒。
新華社4月11日在報道中分析稱,近期,美國新冠疫情看似處于平臺期,但流行病學(xué)家表示,疫情數(shù)據(jù)統(tǒng)計不完全等因素可能使美國日增確診病例數(shù)等指標被嚴重低估,使疫情上升趨勢被“掩蓋”。隨著美國復(fù)活節(jié)、春假等假期來臨,聚會增多,病毒可能加速傳播,美國疫情有可能再次出現(xiàn)上升潮。
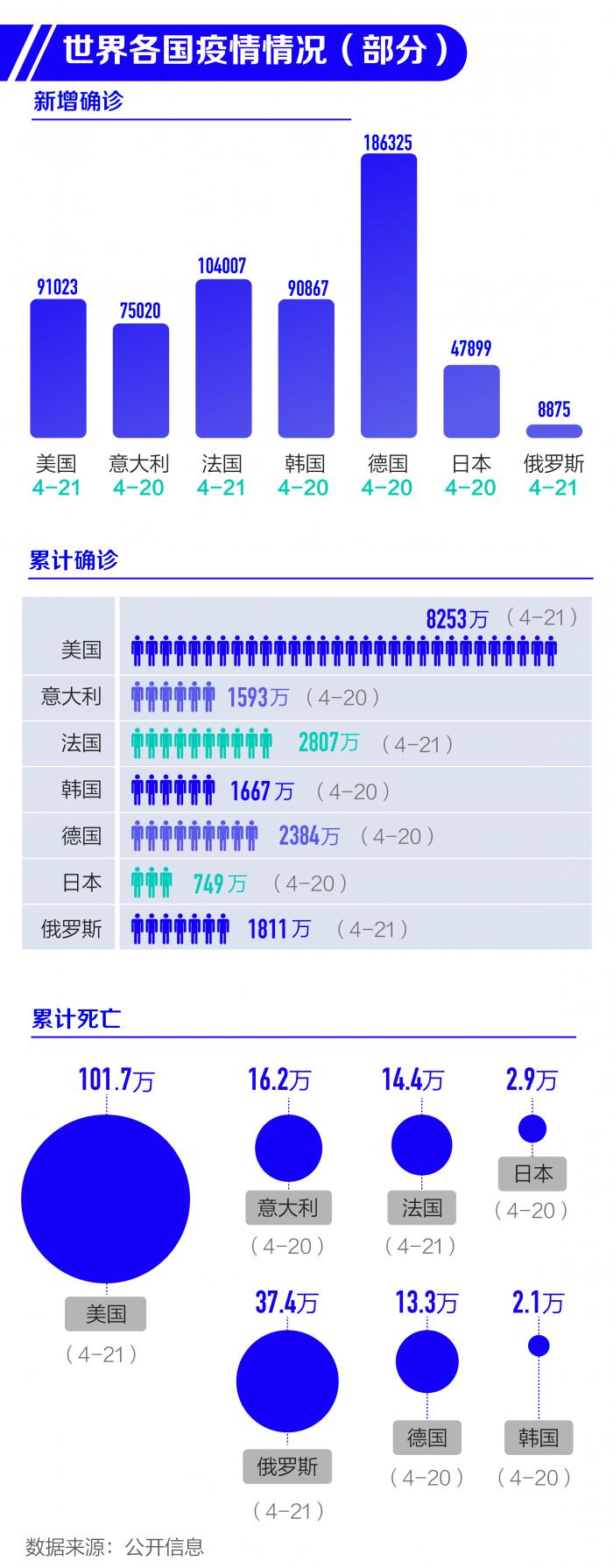
當?shù)貢r間4月21日,意大利衛(wèi)生部公布的最新統(tǒng)計數(shù)據(jù)顯示,過去24小時,該國新增新冠肺炎確診病例75020例,累計確診病例15934437例;新增死亡病例166例,累計死亡病例162264例;新增治愈病例59916例,累計治愈病例14549360例;現(xiàn)存確診病例1222813例。
新華社報道顯示,3月31日,意大利結(jié)束新冠疫情導(dǎo)致的緊急狀態(tài),于4月1日起放寬防疫措施。民眾進入銀行、商店、郵局以及餐館的戶外區(qū)域等場所,或乘坐市內(nèi)公共交通工具時,不再需要出示新冠“綠色通行證”。
法國公共衛(wèi)生部門當?shù)貢r間4月21日公布的數(shù)據(jù)顯示,截至當天下午,法國累計新冠肺炎確診病例達28076047例,24小時新增104007例。累計死亡病例達144799例,24小時新增167例。法國衛(wèi)生部長奧利維耶·韋蘭4月7日在接受媒體采訪時介紹稱,法國已經(jīng)越過疫情反彈高峰。但法國公共衛(wèi)生局隨后呼吁謹慎,稱新冠病毒仍在持續(xù)傳播,目前還不能說疫情反彈峰值已經(jīng)過去。
此外,據(jù)韓國中央防疫對策本部通報,截至4月21日0時,韓國較前一天0時新增感染新冠病毒確診病例90867例,單日確診病例較前一天減少20452例,新增死亡病例147例;累計確診16674045例,累計死亡21667例,平均致死率為0.13%。
另據(jù)韓國媒體報道,韓國疾控部門4月19日表示,韓國首次發(fā)現(xiàn)2例感染新冠重組毒株XE的病例,及1例感染XM的病例。韓國疾控部門對此表示,世衛(wèi)組織將XE與XM都歸為奧密克戎類毒株,特性與奧密克戎原始株BA.1沒有太大不同。鑒于目前尚無關(guān)于其傳播力、致重癥率等信息的資料,防疫部門將加強對變異株的監(jiān)控工作。
韓國疾控部門4月12日表示,國內(nèi)首次發(fā)現(xiàn)感染新冠重組毒株XL的確診病例,正在進行流行病學(xué)調(diào)查。報道稱,XL毒株是迄今發(fā)現(xiàn)的17種重組毒株(XA~XS)的其中之一,由“奧密克戎”原始株BA.1和亞型株BA.2重組而成。不過,目前尚無關(guān)于XL毒株傳播特點的信息,此前僅在英國被發(fā)現(xiàn)。
海外網(wǎng)消息顯示,韓國國務(wù)總理金富謙4月15日宣布,從4月18日起,全面解除保持社交距離的限制,室內(nèi)義務(wù)戴口罩的防疫措施仍將保留。據(jù)了解,該國保持社交距離的防疫措施自2020年3月起實施,至今已有兩年另一個月。另外,4月18日起,在韓國,私人聚集、大型活動集會都不再受人數(shù)限制,高風(fēng)險經(jīng)營場所可以24小時營業(yè),宗教設(shè)施也不再限流。這意味著韓國在疫情防控形勢嚴峻的背景下選擇了“躺平”。
根據(jù)德國聯(lián)邦疾控機構(gòu)羅伯特·科赫研究所發(fā)布的最新統(tǒng)計數(shù)據(jù),截至當?shù)貢r間4月21日零時,德國累計新冠肺炎確診病例達23844536例,較前一日新增186325例;累計死亡133632例,較前一日新增324例。
據(jù)央視新聞消息,法新社4月21日報道稱,一名德國財政部官員表示,正在美國華盛頓參加國際貨幣基金組織和世界銀行春季會議的德國財政部長克里斯蒂安·林德納新冠病毒檢測呈陽性。當日林德納在社交媒體上證實了這一消息。
當?shù)貢r間4月8日,德國衛(wèi)生部長勞特巴赫表示,在立法者否決了擬議的第四劑疫苗任務(wù)后,德國可能需要在今年秋天重新實行在公共場合戴口罩的要求。勞特巴赫指出,此前發(fā)出的結(jié)束強制隔離的建議是出于減輕衛(wèi)生當局的負擔(dān),為此發(fā)出了錯誤信號。但大流行并未過去,“我們每天仍有300多人死亡”,勞特巴赫在新聞發(fā)布會上強調(diào)。
目前,國內(nèi)也遭受著新一輪疫情的沖擊,全國不斷出現(xiàn)散發(fā)本土疫情,單日新冠感染病例數(shù)仍處于高位。
在國務(wù)院聯(lián)防聯(lián)控機制4月19日新聞發(fā)布會上,據(jù)國家衛(wèi)健委疾控局副局長吳良有介紹:3月1日-4月18日,31個省(自治區(qū)、直轄市)和新疆生產(chǎn)建設(shè)兵團累計報告本土感染者497214例,波及除西藏自治區(qū)以外的所有省份。近一段時間,全國疫情形勢呈現(xiàn)逐漸企穩(wěn)態(tài)勢,但地區(qū)之間交叉輸入影響明顯,各地動態(tài)清零的任務(wù)十分艱巨。河北、江蘇、浙江、安徽、廣東、福建、遼寧等省疫情總體趨于平穩(wěn)。吉林省吉林市疫情持續(xù)好轉(zhuǎn),處于下降趨勢,長春市疫情呈現(xiàn)下降態(tài)勢。上海市近日疫情仍處于高位,社區(qū)傳播風(fēng)險仍然較高,防控形勢依然嚴峻,防控任務(wù)仍十分艱巨緊迫。
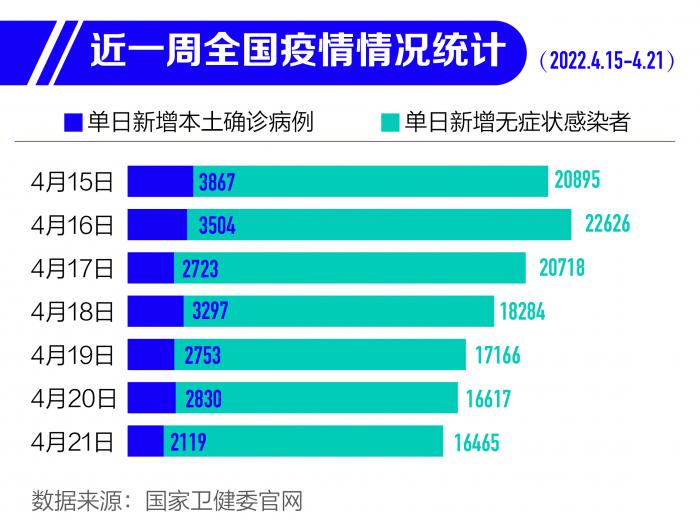
此后,4月19日-22日,國內(nèi)每日新增本土確診病例仍超2000例。4月24日0—24時,31個省(自治區(qū)、直轄市)和新疆生產(chǎn)建設(shè)兵團報告新增確診病例2680例。其中本土病例2666例(上海2472例,吉林79例,黑龍江26例,北京14例,江西14例,浙江13例,湖南12例,內(nèi)蒙古9例,河南5例,青海5例,江蘇4例,遼寧3例,廣東3例,山西2例,山東2例,天津1例,福建1例,四川1例),含899例由無癥狀感染者轉(zhuǎn)為確診病例(上海846例,吉林39例,浙江12例,福建1例,青海1例)。新增死亡病例51例,均為本土病例,在上海;無新增疑似病例。
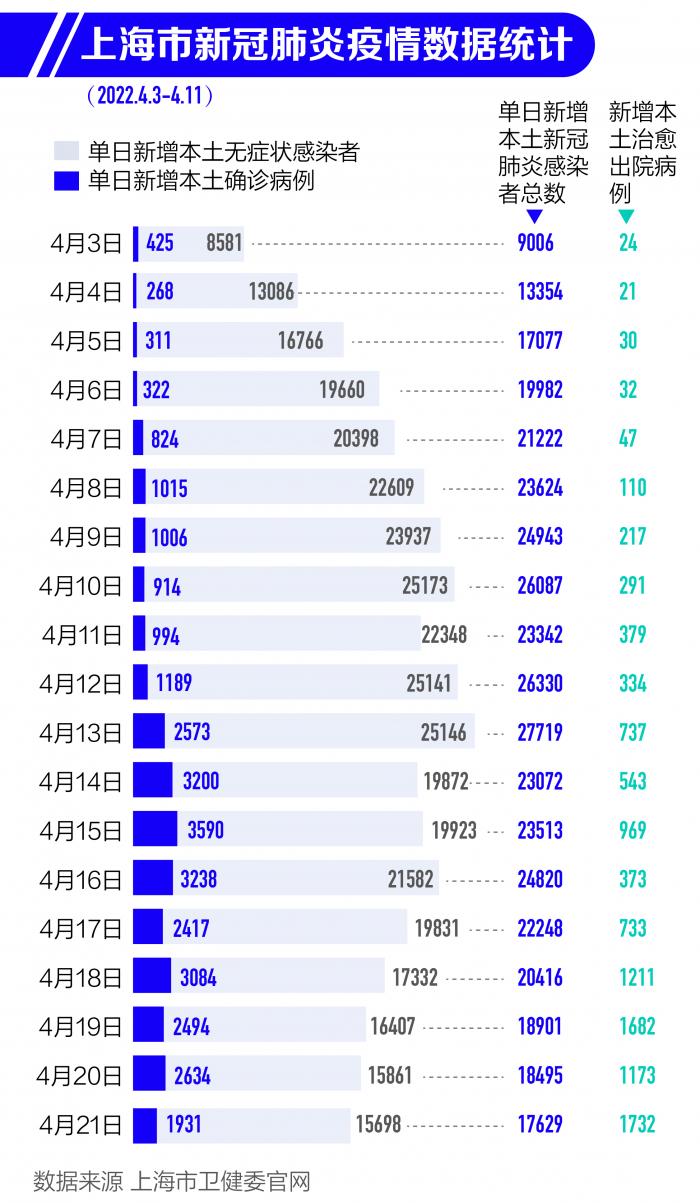
本輪疫情來勢兇猛,上海單日新增新冠肺炎病例首次超過萬例是在4月4日。當日上海新增本土新冠肺炎感染者13354例,其中新增確診268例,新增無癥狀感染者13086例。
隨后,上海疫情持續(xù)處于高位運行。截至4月20日,上海本輪疫情累計感染者超過40萬例。與此同時,截至4月23日24時,上海已累計報告87例死亡病例,現(xiàn)有重型160例,危重型19例。隨后4月24日0—24時,上海新增本土死亡51例。目前本輪疫情中上海累計死亡病例破百。
除了上海外,吉林、黑龍江等地也面臨著疫情防控的挑戰(zhàn)。3月初,吉林省暴發(fā)2022年開年后新一輪疫情,單日新增本土確診病例由個位數(shù)到破百再到破千。經(jīng)過近一個月的努力,吉林省疫情防控工作目前取得了階段性成效,居民的生產(chǎn)生活秩序正逐漸恢復(fù)。
據(jù)吉林衛(wèi)健委消息,4月21日0-24時,全省新增本地確診病例63例,其中長春市53例、吉林市5例、延邊州4例、白城市1例;新增本地?zé)o癥狀感染者244例,其中長春市211例、延邊州14例、吉林市12例、白城市6例、松原市1例。4月21日,全省新增治愈出院確診病例873例,新增解除隔離醫(yī)學(xué)觀察無癥狀感染者1141例。
4月21日上午召開的吉林省疫情防控工作新聞發(fā)布會上,吉林省衛(wèi)健委黨組成員耿建仁通報了該省疫情防控整體工作情況:當前,省新冠肺炎疫情防控工作取得階段性成效,但疫情防控形勢依然嚴峻,仍要繼續(xù)堅持外防輸入、內(nèi)防反彈,堅持“動態(tài)清零”不猶豫、不動搖,抓實抓細疫情防控各項舉措,嚴守不發(fā)生疫情規(guī)模性反彈底線。
黑龍江省衛(wèi)健委官網(wǎng)顯示,4月21日0-24時,該省新增新冠肺炎本土確診病例34例(均在哈爾濱市),新增本土無癥狀感染者56例(均在哈爾濱市)。截至4月21日24時,全省現(xiàn)有本土確診病例304例,本土無癥狀感染者224例;全省現(xiàn)有境外輸入確診病例1例,境外輸入無癥狀感染者5例。
面對近期全國本土聚集性疫情點多、面廣、頻發(fā)的態(tài)勢,我國疫情防控堅持“動態(tài)清零”總方針不動搖。
4月22日,國家衛(wèi)健委疫情應(yīng)對處置工作領(lǐng)導(dǎo)小組專家組組長、清華大學(xué)萬科公共衛(wèi)生與健康學(xué)院常務(wù)副院長梁萬年在接受媒體采訪時強調(diào),堅持“動態(tài)清零”產(chǎn)生的成本和效益,要算大賬、整體賬、動態(tài)賬。現(xiàn)在“動態(tài)清零”的成本,包括新冠疫苗、核酸檢測、方艙建設(shè)、人力資源等投入,如同為應(yīng)對風(fēng)險買了一份保險。面對奧密克戎帶來的風(fēng)險,我國的這份保險惠及了14億的中國人,把疫情控制住不擴散,事實上是給14億人買保險,這些投入都是值得的。
梁萬年指出,新冠疫情無論是從傳播力、致病力、病死率等都遠遠超過流感。梁萬年以香港的真實世界的數(shù)據(jù)來舉例,香港人群的奧密克戎流行株平均病死率是0.75%左右,是流感的七倍到八倍。從老年人群來看的話,特別是80歲以上的老年人群,它的病死率將是普通流感的近百倍。
還有一個關(guān)鍵因素,就是我國老年人的新冠疫苗接種率。根據(jù)國家衛(wèi)健委公布的數(shù)據(jù),截至4月18日我國60歲以上老年人疫苗接種,覆蓋人數(shù)為22552.1萬,完成全程接種21393.8萬,覆蓋人數(shù)和全程接種人數(shù)分別占老年人口的85.41%和81.03%,加強免疫接種已經(jīng)完成15487.4萬人。
“我國老年人口數(shù)量巨大,目前老年人口疫苗接種率相對來說還不夠高。”梁萬年表示,一旦疫情管控放松,它的結(jié)局可以看得很清楚,肯定是病毒廣泛地傳播,老年人群的重癥和死亡數(shù)量是巨大的。對于一個國家來說是一個巨大的災(zāi)難。大量重癥的出現(xiàn),反過來擠兌醫(yī)療系統(tǒng),而且隨著醫(yī)務(wù)人員感染勢必又會造成正常的醫(yī)療服務(wù)的需求得不到有效滿足,將會形成一種惡性循環(huán)。
第二部分:序貫加強免疫接種
“近日,經(jīng)國務(wù)院聯(lián)防聯(lián)控機制批準,國家衛(wèi)生健康委已經(jīng)開始部署序貫加強免疫接種。”在2月19日舉行的國務(wù)院聯(lián)防聯(lián)控機制新聞發(fā)布會上,國家衛(wèi)健委疾控局副局長吳良有表示。
對于“序貫免疫”這一概念,中國疾控中心免疫規(guī)劃首席專家王華慶解釋稱,序貫免疫是指采用不同技術(shù)路線的疫苗,按照一定的時間間隔和一定的劑次,為了預(yù)防效果提高或者進一步降低嚴重不良反應(yīng)風(fēng)險,進行接種的一種策略。
在上述發(fā)布會上,吳良有具體介紹了目前國內(nèi)序貫加強免疫的兩種方案:
其一是同源加強免疫接種。此前,凡全程接種國藥中生北京公司、武漢公司、北京科興公司滅活疫苗,以及天津康希諾公司的腺病毒載體疫苗滿6個月的18歲以上目標人群,可以進行一劑次同源加強免疫,也就是用原來的疫苗進行加強。此外,國務(wù)院聯(lián)防聯(lián)控機制還批準了深圳康泰公司和醫(yī)科院生物所新冠病毒滅活疫苗的同源加強免疫接種。
其二是異源加強免疫接種。序貫加強免疫策略實施后,完成全程接種上述三種滅活疫苗的目標人群,還可以選擇智飛龍科馬的重組蛋白疫苗或康希諾的腺病毒載體疫苗進行序貫加強免疫。
吳良有同時指出,無論是同源加強還是序貫加強,都是在完成全程接種滿6個月的18歲以上人群中實施。對于目標人群而言,選擇其中一種即可。研究數(shù)據(jù)表明,同源加強免疫和序貫加強免疫,都能夠進一步提高免疫效果。
其實,這并非我國首次開展序貫加強免疫。王華慶在發(fā)布會上指出,此前序貫免疫主要應(yīng)用于脊髓灰質(zhì)炎減毒活疫苗(即“小兒麻痹糖丸”),全程接需4劑次,前兩劑次接種滅活三價脊髓灰質(zhì)炎疫苗,后兩劑次接種兩價減毒活疫苗。
“對于變異性強又很難對付的病毒,經(jīng)常采用序貫免疫的方式接種。”對于為何此時要推行序貫加強免疫接種,國務(wù)院聯(lián)防聯(lián)控機制科研攻關(guān)組疫苗研發(fā)專班專家組成員邵一鳴解釋稱,一是不同疫苗之間可以優(yōu)勢互補,二是不同人體質(zhì)不一樣,可能對某一類疫苗產(chǎn)生的副作用多一些,采用不同技術(shù)路線疫苗接種可以規(guī)避副反應(yīng)。
自序貫免疫部署宣布后,哪些人群能夠進行序貫加強免疫接種備受關(guān)注。王華慶對此表示,序貫加強免疫需滿足以下條件:
第一,接種對象為18歲以上的人群;
第二,接種人群要完成2劑次的滅活疫苗接種,而且這2劑次接種的是國藥中生北京公司、北京科興公司、國藥中生武漢公司的新冠病毒滅活疫苗;
第三,接種對象要全程完成2劑次的接種,序貫加強免疫接種間隔不能短于6個月;
第四,接種對象在序貫加強免疫之前沒有進行過加強免疫,即沒有打過第三針。
此外,王華慶還提醒說,接種時要做好個人防護,將自己的健康狀況如實向接種醫(yī)生反映,由接種醫(yī)生判斷是否有禁忌證、是否需緩種;接種疫苗后要留觀30分鐘,發(fā)生懷疑與疫苗接種有關(guān)的不良反應(yīng)時,如持續(xù)時間較長、癥狀比較嚴重,一要向接種單位報告,二要及時就醫(yī)。
自序貫免疫政策出臺后,目前福建、山東、湖南、河南、重慶、成都、西安等多地已啟動新冠疫苗序貫加強免疫接種。而在此次之前,國外已有類似部署與實施。中國疾控中心免疫規(guī)劃首席專家王華慶指出,在美洲、歐洲、東南亞的一些國家,已經(jīng)開始實施序貫加強免疫接種。
據(jù)悉,美國食品和藥物管理局2021年10月20日修訂了新冠疫苗緊急使用授權(quán),允許接種者選用與此前所接種疫苗品牌不同的疫苗加強針。加拿大國家免疫咨詢委員會2021年6月宣布新規(guī)定,允許混合接種新冠疫苗,以便進一步加快疫苗接種進度。韓國、英國等國已于2021年上半年就新冠疫苗序貫接種展開臨床試驗。
在多國實施序貫接種不久,基于現(xiàn)有研究數(shù)據(jù),世衛(wèi)組織2021年12月16日發(fā)布了新冠疫苗“混打”接種臨時指南(以下稱“指南”)。指南建議,如果第一針接種的是病毒載體疫苗,后續(xù)無論是第二劑或是加強針均可接種信使核糖核酸(mRNA)疫苗;反之亦然。如果起初接種滅活疫苗,后續(xù)可接種病毒載體疫苗或mRNA疫苗。
世衛(wèi)組織表示,基于疫苗的安全性、免疫力和有效性,標準做法是接種全程使用同一廠家生產(chǎn)的疫苗。但考慮到疫苗可及性,可靈活搭配使用不同廠家生產(chǎn)的疫苗。不過,世衛(wèi)組織同時也強調(diào),只有認真考慮疫苗的供應(yīng)情況及特定疫苗產(chǎn)品的潛在優(yōu)勢和風(fēng)險,才能開展“混打”。
第三部分:誰是下一個序貫加強疫苗?
據(jù)21世紀經(jīng)濟報道記者統(tǒng)計,截至目前我國共7款新冠疫苗獲批上市或緊急使用,分別為國藥北京和國藥武漢、科興中維、康泰生物(300601.SZ)、中國醫(yī)科院生物所的滅活疫苗,康希諾(688185.SH)的腺病毒載體疫苗,以及智飛生物(300122.SZ)的重組蛋白疫苗。目前國內(nèi)主流新冠疫苗為滅活劑型,生產(chǎn)廠商主要包括國藥北京、國藥武漢、科興中維、康泰生物、中國醫(yī)科院生物所。隨著序貫加強獲批應(yīng)用,重組蛋白疫苗生產(chǎn)商智飛生物(300122.SZ)、腺病毒載體疫苗生產(chǎn)商康希諾(688185.SH)將受益。與此同時,沃森生物的mRNA疫苗、麗珠集團的重組蛋白疫苗仍處于臨床III期試驗階段。
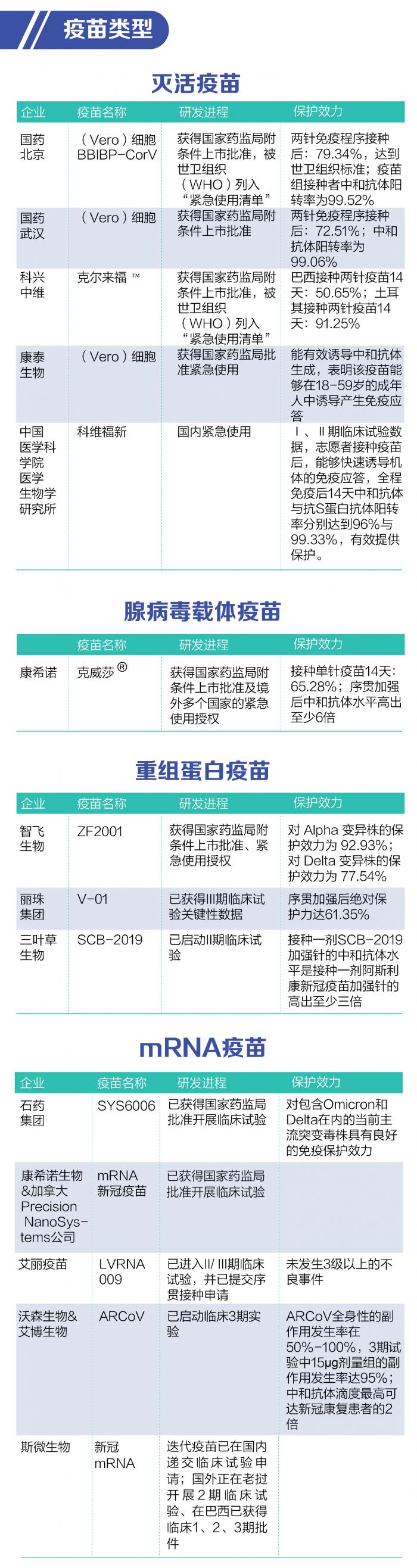
3.1 已獲批序貫疫苗的接種前景
2月19日,據(jù)國務(wù)院聯(lián)防聯(lián)控機制新聞發(fā)布會指出,序貫加強免疫策略實施后,完成全程接種三種滅活疫苗(國藥北京、國藥武漢和科興中維滅活疫苗)的目標人群,還可以選擇智飛龍科馬的重組蛋白疫苗或康希諾的腺病毒載體疫苗進行序貫加強免疫。由此,康希諾生物的腺病毒載體疫苗克威莎?與智飛龍科馬的重組新冠蛋白疫苗(CHO細胞)ZF2001正式獲批進入序貫加強針行列。
3.1.1 康希諾生物克威莎?疫苗
2021年,康希諾聯(lián)合中國工程院院士、軍科院研究員陳薇團隊開發(fā)的重組新型冠狀病毒疫苗(5型腺病毒載體)克威莎?獲得國家藥監(jiān)局附條件上市批準及境外多個國家的緊急使用授權(quán)。
康希諾官網(wǎng)顯示,克威莎?采用1劑接種方案,可大大縮短接種周期,且疫苗可在2°C至8°C 之間長期穩(wěn)定儲運,可大幅度降低接種管理成本。據(jù)21世紀經(jīng)濟報道記者了解,目前康希諾產(chǎn)能瓶頸得以緩解,有望增加出貨規(guī)模。此前康希諾僅有天津廠區(qū)產(chǎn)能2億劑/年;今年1月28日,康希諾位于上海寶山工廠投產(chǎn),增加2億劑/年產(chǎn)能。
2021年12月,國際權(quán)威醫(yī)學(xué)期刊《柳葉刀》公布了克威莎?的全球多中心Ⅲ期臨床試驗結(jié)果。數(shù)據(jù)顯示,在18歲及以上健康人群中接種1劑克威莎?后安全、有效。14天后,重癥保護率為96.0%,總體保護率為63.7%,達到世界衛(wèi)生組織建議的新冠疫苗保護率標準,無一例與疫苗相關(guān)的嚴重不良反應(yīng)發(fā)生。
自康希諾的腺病毒載體疫苗正式成為序貫加強免疫的選擇之一。國金證券分析認為,克威莎?注射劑型將展開同源和交叉序貫接種,皆會增加國內(nèi)市場銷售。
根據(jù)2022年1月發(fā)表在BioRxiv 上的論文顯示,克威莎?針對奧密克戎的中和抗體水平是滅活疫苗同源加強的6倍,重組蛋白疫苗序貫加強的3倍。而此前由江蘇省疾控中心進行的臨床試驗數(shù)據(jù)顯示,克威莎?吸入劑型用于新冠交叉加強接種,安全性與免疫原性皆優(yōu)。吸入劑型加強后的14天和28天,受試者的中和抗體水平較滅活同源加強組分別高6.7-10.7倍。
據(jù)悉,克威莎?已接受世衛(wèi)組織(WHO)對其提交的納入緊急使用清單(EUL)申請后的核查。結(jié)合目前疫情形勢,如果被納入EUL,康希諾的新冠疫苗海外訂單有望獲得大幅增長。
3.1.2 智飛生物重組蛋白新冠疫苗“ZF2001”
此次獲批的序貫加強疫苗中,重組蛋白疫苗(CHO細胞)ZF2001 (下稱“ZF2001 ”)由智飛生物全資子公司智飛龍科馬與中科院微生物研究所合作研發(fā),采用重組蛋白技術(shù)路線,為首個獲批的國產(chǎn)重組新冠病毒蛋白疫苗。
作為新冠疫苗五大技術(shù)路線之一,重組蛋白路線的疫苗產(chǎn)品對生產(chǎn)車間的生物安全等級要求低,且具備純度高、安全性更好、能實現(xiàn)高產(chǎn)量、低成本等優(yōu)勢。
2021年3月,ZF2001獲得國家藥品監(jiān)督管理局組織論證同意緊急使用,成為國內(nèi)第四款獲批緊急使用的新冠疫苗;同月,該疫苗在烏茲別克斯坦獲得注冊上市,成為國際首個注冊上市的重組亞單位新冠疫苗;而今年2月,該疫苗獲批作為新冠滅活疫苗的序貫(異源)加強針。3月2日,智飛生物發(fā)布公告稱,公司從國家藥監(jiān)局官網(wǎng)查詢獲悉,重組新型冠狀病毒疫苗(CHO細胞)獲批附條件上市,適用于預(yù)防新冠病毒感染所致的疾病。
無論獲批上市還是緊急使用,均基于該疫苗的安全性和有效性。2021年8月27日,智飛生物官方發(fā)布了重組新型冠狀病毒疫苗(CHO細胞)的國際多中心III期臨床試驗數(shù)據(jù)。數(shù)據(jù)顯示,共監(jiān)測到全程接種后的主要終點病例數(shù)221 例,對于任何嚴重程度的COVID-19 的保護效力為81.76%,達到WHO 要求的新冠疫苗有效性標準。其中對于COVID-19 重癥及以上病例、死亡病例的保護效力均為100%。根據(jù)基因分型后的初步分析結(jié)果,該疫苗對Alpha 變異株的保護效力為92.93%;對Delta 變異株的保護效力為77.54%。從安全性看,總體不良事件/反應(yīng)的發(fā)生率,疫苗組與安慰劑組無顯著差異,安全性良好。
3.2 潛在新冠疫苗的序貫奔赴之路
3.2.1 麗珠集團重組蛋白疫苗
V-01是麗珠集團控股附屬公司珠海市麗珠單抗生物技術(shù)有限公司(“麗珠單抗”)與中國科學(xué)院生物物理研究所合作研發(fā)的創(chuàng)新型新冠重組蛋白疫苗,為兩針接種,其抗原結(jié)構(gòu)中融合了作為生物佐劑的人源干擾素,可顯著增強病毒中和抗體水平,并產(chǎn)生有效的細胞應(yīng)答。
V-01于2021年初獲國家藥監(jiān)局批準進行臨床試驗,隨后獲批在菲律賓、巴基斯坦、俄羅斯、馬來西亞等國開展序貫加強Ⅲ期臨床試驗。2月17日,麗珠集團(000513.SZ)發(fā)布公告稱,V-01已完成序貫加強Ⅲ期臨床試驗的中期主數(shù)據(jù)分析,并獲得了關(guān)鍵性數(shù)據(jù)。
根據(jù)現(xiàn)階段分析試驗結(jié)果,V-01序貫加強組和兩針滅活疫苗組人年發(fā)病率分別為6.73%和12.80%,具有顯著性差異;V-01序貫加強后的絕對保護力為61.35%,具有顯著有效性,已滿足WHO標準。此次試驗全部有效送檢標本中60個的新冠病毒基因分型一代測序均為Omicron(其余仍在進行二代測序),表明V-01序貫加強對于Omicron感染導(dǎo)致的COVID-19可產(chǎn)生良好的保護力。同時,未發(fā)現(xiàn)有值得關(guān)注的安全性問題。
據(jù)悉,目前V-01的生產(chǎn)已實現(xiàn)原材料國產(chǎn)化,原材料供應(yīng)鏈穩(wěn)定,儲備充足。基于先進的分子設(shè)計,V-01佐劑采用常規(guī)鋁佐劑,擺脫了蛋白類疫苗對毒副作用大且專利壟斷的強佐劑的依賴,有助于促進持續(xù)穩(wěn)定的產(chǎn)能釋放。預(yù)計今年制劑產(chǎn)能達到15億劑。
對于V-01的未來市場,麗珠集團方面回應(yīng)稱,雖然國內(nèi)的新冠疫苗接種率已經(jīng)很高,且部分省份已經(jīng)陸續(xù)啟動加強針的接種,但是面對全球變異株病毒疫情持續(xù)傳播的挑戰(zhàn),國家整體防疫政策上也在積極支持更多技術(shù)路線疫苗的加速研發(fā)。如果麗珠V-01在國內(nèi)上市,有望為未來持續(xù)加強免疫提供更多靈活科學(xué)的方案選擇,為抗疫貢獻一份力量。
“對于公司而言,收益固然重要,但是如果我們的疫苗能夠?qū)箵粢咔槠鸬揭欢ㄗ饔茫鐣找姹绕髽I(yè)收益更為重要,這也是我們作為藥企的責(zé)任與擔(dān)當。”面對商業(yè)利益與社會效益的平衡,麗珠集團表示。
3.2.2 三葉草重組蛋白疫苗
另一潛在的重組蛋白疫苗企業(yè)為三葉草生物(02197.HK),其核心產(chǎn)品為重組蛋白新冠疫苗SCB-2019(CpG 1018/鋁佐劑)(下稱“SCB-2019”)。SCB-2019是一款三聚體重組蛋白新冠候選疫苗,運用兩劑接種方案,采取肌肉注射的方式,目前臨床試驗已達到疫苗保護效力的主要終點及次要終點。
近日,三葉草生物發(fā)布公告表示,1月21日《柳葉刀》刊登了SCB-2019的最終保護效力數(shù)據(jù)。研究顯示,接種兩劑SCB-2019可對重組新冠病毒(SAR-CoV-2)變異株造成任何嚴重程度的COVID-19提供顯著保護效力。預(yù)防任何毒株引起的重度和需住院治療的新冠肺炎(COVID-19)保護效力為100%,預(yù)防任何毒株引起的中度至重度新冠肺炎的保護效力為83.7%,預(yù)防任何毒株引起的任何嚴重程度的新冠肺炎的保護效力為67.2%。從病毒變種看,預(yù)防因三種主要變種引起的任何嚴重程度COVID-19的疫苗效力分別為78.7%(德爾塔變種)、91.8%(伽馬變種)及58.6%(繆變種)。效力分析的隨訪期間并未出現(xiàn)安全問題,各組發(fā)生不良事件的比率相當。
在序貫加強的部署背景下,SCB-2019的異源加強試驗也取得了初步數(shù)據(jù)。巴西開展的一項2期臨床試驗初步顯示,在既往已接種兩劑阿斯利康疫苗的個體中,接種一劑SCB-2019加強針的中和抗體水平是接種一劑阿斯利康新冠疫苗加強針的高出至少三倍。此外,同源加強的試驗數(shù)據(jù)也即將出爐。據(jù)三葉草發(fā)布的公告,SPECTRA試驗于2022年1月修訂后,開始將SCB-2019作為同源加強劑進行評估試驗。II期臨床試驗2021年11月在巴西開始,初步結(jié)果預(yù)計于2022年上半年發(fā)布。
從產(chǎn)能看,三葉草生物規(guī)劃新冠疫苗年產(chǎn)量達10億劑,。公告顯示,三葉草生物旗下公司已與聯(lián)合國兒童基金會(UNICEF)簽訂長期疫苗供應(yīng)協(xié)議,約定2022年向COVAX“新冠肺炎疫苗實施計劃”提供4.14億劑SCB-2019疫苗。
三葉草方面表示,預(yù)計于2022年中完成向國家藥監(jiān)局的注冊申請,并于2022 年第三季度完成向世界衛(wèi)生組織及歐洲藥品管理局的注冊申請,一旦獲得附條件批準,就啟動SCB-2019產(chǎn)品上市。
3.3 國產(chǎn)mRNA新冠疫苗加速度
mRNA疫苗作為一種新型的疫苗技術(shù),與減毒或滅活疫苗不同,mRNA只表達特定抗原并定向誘導(dǎo)免疫反應(yīng)。此外,它促進體液和細胞免疫反應(yīng),并誘導(dǎo)先天免疫系統(tǒng)。與DNA疫苗相比,mRNA更安全有效,因為表達不需要進入細胞核,隨機基因組整合的概率幾乎為零。此外,mRNA在細胞中會在較短時間內(nèi)(2-3天)降解,并且開發(fā)周期短且具有廣譜性。而且,通過工程化改造mRNA疫苗可大大增加其穩(wěn)定性及免疫效力。
所以,目前,mRNA新冠疫苗在國際的認可度較高。不少研究數(shù)據(jù)也證實了mRNA疫苗更具優(yōu)勢。
近一年以來,mRNA疫苗技術(shù)路線的優(yōu)勢及其在應(yīng)對全球新冠疫情中的突出優(yōu)勢,成為我國醫(yī)藥公司研發(fā)新冠疫苗的重心。不少企業(yè)開始研發(fā)mRNA新冠疫苗,從艾博生物和艾美疫苗再到如今獲得臨床試驗批準的石藥集團和康希諾,我國mRNA疫苗研發(fā)的勢頭迅猛。
3.3.1 石藥集團和康希諾mRNA疫苗獲批臨床
2022年4月3日至4日,兩款mRNA疫苗接連獲得國家藥品監(jiān)督管理局頒發(fā)的臨床試驗批準文件,分別是石藥集團自主研發(fā)的SYS6006和康希諾與加拿大Precision NanoSystems公司共同研制的新型冠狀病毒mRNA疫苗。
這兩款mRNA疫苗臨床前研究結(jié)果均顯示:針對當前主流突變毒株的免疫保護效力,可以更有效地保護機體免受現(xiàn)有變異株的感染。這意味著,這兩款新的mRNA疫苗在抗擊Omicron新冠肺炎中可以發(fā)揮重要的作用。
石藥集團研發(fā)的mRNA新冠疫苗SYS6006是特別針對新型冠狀病毒變異毒株而自主研發(fā)的,其臨床前研究表明,該產(chǎn)品對包含Omicron和Delta在內(nèi)的當前主流突變毒株具有良好的免疫保護效力;通過體液免疫和細胞免疫對機體提供免疫保護,并可產(chǎn)生記憶性B細胞,提供長效保護效力。
此外,石藥集團還表示,臨床前安全性評價數(shù)據(jù)也充分證明了該產(chǎn)品的安全性。該產(chǎn)品使用先進的生產(chǎn)技術(shù),工藝過程高度可控,批間一致性好,容易實現(xiàn)放大和產(chǎn)業(yè)化;而且穩(wěn)定性好,可在2℃-8℃之間長期儲藏。本集團對mRNA技術(shù)的關(guān)鍵生產(chǎn)原料和輔料實現(xiàn)了內(nèi)化生產(chǎn)和國產(chǎn)化替代,可滿足大規(guī)模產(chǎn)能供應(yīng)需求。
康希諾研發(fā)的疫苗也是針對現(xiàn)有變異株具有更好保護效果。其臨床前研究結(jié)果顯示,該款疫苗可以誘導(dǎo)出針對多種世界衛(wèi)生組織(WHO)認定的重要變異株(包括當前流行株奧密克戎)的高滴度中和抗體,廣譜性更強,可以更有效地保護機體免受現(xiàn)有變異株的感染。
同時,康希諾生物表示未來將充分依托包括病毒載體技術(shù)、mRNA 技術(shù)在內(nèi)的核心技術(shù)平臺,持續(xù)開展針對性疫苗的研究與開發(fā)。
3.3.2 艾麗疫苗mRNA新冠疫苗已進入II/ III期臨床試驗
新型冠狀病毒mRNA疫苗LVRNA009是艾美疫苗自主研發(fā),并在2021年3月獲得國家藥監(jiān)局批準開展臨床試驗,是繼艾博生物和斯微生物之后的第三款獲批臨床試驗的國產(chǎn)mRNA新冠疫苗。目前,LVRNA009已進入II/ III期臨床試驗,并已提交序貫接種申請。
2022年1月8日,艾美疫苗I期臨床試驗數(shù)據(jù)顯示安全性和耐受性結(jié)果良好。LVRNA009所有總的不良事件發(fā)生的級別都是在1-2級,沒有發(fā)生3級以上的不良事件;也沒有發(fā)生SAE和特別關(guān)注的征集性的不良事件。整個試驗期間,沒有發(fā)生三級以上的發(fā)熱的情況。
具體來看,活病毒中和抗體檢測結(jié)果顯示,該疫苗的活病毒中和抗體幾何平均滴度(GMT)為,“成人低劑量組第56天的GMT為570多,成人中劑量組第56天的GMT為1500多,成人高劑量組第56天的GMT為840多”。相比同類產(chǎn)品的I期臨床試驗結(jié)果,顯示出非常好的安全性和免疫原性。
除了安全性和免疫原性外,LVRNA009對保存溫度的要求并不“苛刻”。據(jù)了解,該疫苗可在2℃~8℃的條件下保存1個月,在-20℃的條件下保存12個月。
從產(chǎn)業(yè)化方面,據(jù)悉艾美疫苗目前正在多地布局mRNA疫苗的模塊化生產(chǎn)車間,計劃2022年6月份能夠進行mRNA新冠疫苗工程批生產(chǎn)。另外,在上海、北京等地,艾美疫苗擬新建工廠,預(yù)計今年底可建成,明年投產(chǎn),預(yù)計年產(chǎn)能達4億劑。
此外,艾美疫苗還有一款新型冠狀病毒Delta變異株mRNA疫苗在研,處于臨床前階段。
3.3.3沃森生物&艾博生物3期臨床試驗基本結(jié)束
mRNA新冠疫苗ARCoV(下稱“ARCoV”)由中國軍事醫(yī)學(xué)科學(xué)院(AMMS)、艾博生物、沃森生物共同研制,目前已完成1期、2期臨床研究,3期臨床試驗基本結(jié)束,已進入相關(guān)數(shù)據(jù)清理階段。
2021年11月,沃森生物獲批在廣西和云南開展18歲以上人群的“新冠滅活疫苗+新冠mRNA疫苗”序貫接種臨床試驗。目前上述臨床試驗已完成入組接種。今年1月24日,國際權(quán)威醫(yī)學(xué)期刊柳葉刀子刊《Lancet Microbe》在線刊登了ARCoV疫苗的一期臨床試驗結(jié)果。結(jié)果顯示,ARCoV在5種不同劑量(5ug、10ug、15ug、20ug、25ug)下均安全性和耐受性良好,且能夠誘導(dǎo)強烈的體液和細胞免疫反應(yīng),其中15ug試驗組誘導(dǎo)的中和抗體滴度最高,大約是新冠康復(fù)患者的2倍。
ARCoV穩(wěn)定性較高,可及性有所增強,可在正常冰箱溫度下(2-8℃)長期保持穩(wěn)定(至少6個月)。相比之下,Moderna的mRNA疫苗需要在-20℃下保存和運輸(在2-8℃穩(wěn)定30天),而輝瑞mRNA疫苗需要在-70℃下保存和運輸運輸(在2-8℃穩(wěn)定5天)。
不過同樣值得關(guān)注的是,ARCoV全身性的副作用發(fā)生率在50%-100%,3期試驗中15μg劑量組的副作用發(fā)生率也高達95%。
據(jù)沃森生物3月21日披露,目前,新冠mRNA疫苗國內(nèi)三期臨床的現(xiàn)場工作基本結(jié)束,正在進行數(shù)據(jù)整理和持續(xù)血清檢測,國際多中心三期臨床試驗也已取得了階段性進展,已經(jīng)在開展病例收集的工作,并持續(xù)與當?shù)厮幈O(jiān)部門保持溝通。
第四部分:誰有望贏得下半場?
由于獲批上市較早,國藥中生、科興中維等成為新冠疫苗“上半場”的受益者。其中,國藥北京和國藥武漢的新冠病毒滅活疫苗分別于2020年12月30日和2021年2月25日在國內(nèi)附條件上市。2020年6月,國家批準科興新冠疫苗納入緊急使用。2021年2月5日,國家藥監(jiān)局依法批準科興新冠疫苗在國內(nèi)附條件上市。
據(jù)“中國生物”官方微信公眾號發(fā)文,截至2021年11月16日,國藥中生已累計向國內(nèi)外生產(chǎn)供應(yīng)新冠疫苗近25億劑次,年產(chǎn)能已超過70億劑次。截至目前,中國生物新冠疫苗已在全球10個國家注冊上市,112個國家、地區(qū)及國際組織批準緊急使用或市場準入。
除國藥外,位于新冠疫苗第一梯隊的還有科興中維。財報顯示,2021年上半年科興中維銷售額為110億美元(約700億元),凈利潤為86億美元(約540億元)。其業(yè)績暴漲主要來源為自主研制的新冠病毒滅活疫苗克爾來福(CoronaVac)。此外,據(jù)中國生物制藥披露的財報顯示,2021年其應(yīng)占聯(lián)營公司溢利達136.3億元,同比暴增47倍。財報特別提到,國產(chǎn)新冠疫苗廠商科興中維在聯(lián)營公司中的表現(xiàn)“尤為突出”。由此,不少投資者根據(jù)中國生物制藥在科興中維的持股比例,推算出科興中維2021年的凈利潤或超過900億元。
據(jù)科興中維副總經(jīng)理廉曉娟去年11月18日公開透露,科興中維已經(jīng)向全球供應(yīng)22億劑新冠疫苗,其中13億劑供應(yīng)國內(nèi)市場,另外9億劑供應(yīng)國際市場。2021年6月1日,中國科興新冠疫苗被納入WHO的緊急使用清單。截至2022年1月29日,科興已向全球供應(yīng)了27億劑新冠疫苗,占全球新冠疫苗供應(yīng)總量的23%。
目前,科興新冠疫苗總體年產(chǎn)能超20億劑,已獲得60個國家、地區(qū)和國際組織的緊急使用授權(quán)或附條件上市。
不過,中信證券醫(yī)藥首席分析師陳竹向21世紀經(jīng)濟報道記者表示,新冠疫苗的競爭必定進入下半場,最大贏家很可能是(國藥)中生集團,因為其本身有滅活疫苗,重組蛋白疫苗和mRA疫苗也在快馬加鞭地入場,是疫苗種類最全的“國家隊”。
借助新冠疫苗的紅利,另外三家A股上市公司的在銷產(chǎn)品業(yè)績迅速增長的同時,不得不直面同行競爭。根據(jù)新發(fā)布的業(yè)績快報,2021年安徽龍科馬的母公司智飛生物(300122.SZ)實現(xiàn)營收306.37億元,同比增長101.68%;實現(xiàn)歸母凈利潤101.97億元,同比增長208.88%。根據(jù)上半年的新冠疫苗業(yè)績貢獻占比推算,公司全年新冠疫苗的收入和凈利潤分別約為110億、70億元。在新冠疫苗的貢獻下,康希諾生物(688185.SH)也一舉扭虧為盈。業(yè)績報告顯示,2021年營收近43億元,同比增長171倍,實現(xiàn)凈利潤19.1億元。而根據(jù)年度業(yè)績預(yù)告,康泰生物(300601.SZ)2021年歸母凈利潤規(guī)模至少超過12億元,預(yù)計同比增幅最高達到106.13%。
然而,面對受限于自身產(chǎn)能、研發(fā)上市進程、市場競爭激烈等因素,三家企業(yè)的市場份額仍不及國藥、科興等“先行者”。
不過,陳竹指出,與疫情暴發(fā)初期相比,疫苗接種需求和熱度肯定有所下降,但像流感一樣,每年可能存在重復(fù)接種的概率。
目前看來,上半場的新冠疫苗市場已被占據(jù)八九。隨著序貫加強免疫接種推進,國內(nèi)后發(fā)的新冠疫苗企業(yè)在加快步伐進入序貫加強的競爭賽道。不過由于“入場”較晚,大多仍處于臨床試驗階段,其疫苗獲批上市的時間仍是未知。再加上受到產(chǎn)品管線、自身產(chǎn)能、同行競爭等因素影響,在新冠疫苗的后半場之爭中能否勝出,仍值得期待。

















